El presente trabajo tiene un doble objetivo: por un lado, contextualizar el tratamiento de la asistencia farmacéutica en el ordenamiento jurídico español; y por otro lado, analizar el marco regulatorio de la modalidad de dispensación de medicamentos online de manera concisa.
Sumario
2. Antecedentes en la venta a distancia de medicamentos. El caso DocMorris
3. Régimen jurídico actual en España
3.2. Objeto: Medicamentos para uso humano sin receta
3.3. Requisitos: El logotipo común europeo como sinónimo de legalidad
3.4. Obligaciones y restricciones del farmacéutico en el proceso de venta
3.5. Breve mención a la publicidad de los medicamentos
Introducción
Tal y como sintetiza la Comisión Nacional de los Mercados y la Competencia en su estudio del pasado mes de octubre[1], las tres razones que hacen que el sector farmacéutico contemporáneo en España sea un sector regulado son la especial salvaguardia que merece la salud pública; la existencia de fallos de mercado en los que la libre y absoluta competencia no conduciría a la eficiencia económica; y su relevancia en el sector económico, sobre todo si tenemos en cuenta que la práctica totalidad de los medicamentos autorizados son financiados por el Sistema Nacional de Salud (un 94%).
Es en el artículo 43.2[2] del texto constitucional donde se atribuye a los poderes públicos la tutela de la salud pública “a través de medidas preventivas y de las prestaciones y servicios necesarios”. Para poder cumplir eficazmente con su mandato, se contiene en la Ley 14/1986, de 25 de abril, General de Sanidad, una de las decisiones clave fue la descentralización de competencias a favor de las Comunidades Autónomas para legislar sobre las Oficinas de Farmacia. Desde hace más de una década todas las Comunidades Autónomas las han asumido, lo que supone una “descentralización completa de la asistencia sanitaria del Sistema Nacional de Salud, incluida la de la prestación farmacéutica”[3].
En lo relativo a la naturaleza de la asistencia farmacéutica, es paradigmática la STS Sala de lo Contencioso, 1960/1998, de 24 de marzo, pues en su fundamento jurídico 6º se establece expresamente que es una actividad de “servicio público impropio” o de “servicio de interés público”. Se reconoce así que es una actividad privada ejercida por un profesional liberal pero que obedece a un objetivo de interés público y que, por tanto, debe cumplir con las normas administrativas impuestas (como es la obtención de autorización administrativa previa. En la misma línea, véanse las SSTS de 30 de junio de 1995 y de 4 de abril de 1997; y la STC 83/1984, de 24 de julio.
En este sector, el regulador sí es distinto al prestador de la asistencia farmacéutica. Sin embargo, observamos que no se limita a supervisar y a tener una posición de garante, sino que la Administración Pública (y, destacadamente, la Agencia Española de Medicamentos y Productos Sanitarios —AEMPS—) siguen determinando el qué, cuánto, cuándo y cómo, hasta tal punto de resultar contrario a la normativa europea. Como consecuencia, es petición reiterada en todos los niveles que se proceda a la liberalización de las oficinas farmacéuticas: destacamos aquí al Consejo General de Colegios Oficiales de Médicos de España[4] , el referido estudio de la CNMC y a la propia Comisión Europea[5].
Para finalizar, apuntar que en el sector farmacéutico español existe una separación de actividades. Las actividades propias del proceso farmacéutico son realizadas por múltiples sujetos, preceptivamente independientes e incompatibles entre ellos, e incluyen: investigación y producción de medicamentos por parte de los laboratorios, autorización de la Administración, distribución de los medicamentos por los distribuidores mayoristas, o dispensación al paciente por las Oficinas de Farmacia y Farmacias Hospitalarias.
Antecedentes en la venta a distancia de medicamentos. El caso DocMorris.
En la legislación española reciente, la primera referencia a la dispensación a distancia de medicamentos se encuentran en la Ley 25/1990, de 20 de diciembre, del Medicamento, precisamente al señalar tajantemente en su artículo 88.1, apartado b, que "la presencia y actuación profesional del farmacéutico es condición y requisito inexcusable para la dispensación al público de medicamentos", al hablar de la ordenación de las Oficinas de Farmacia. En esta línea, se destaca el pronunciamiento del Tribunal Constitucional sobre la constitucionalidad de la Ley 5/1999, de 21 de mayo, de Ordenación Farmacéutica de Galicia, en la que se apuntaba como excepción a la presencia necesaria del farmacéutico la dispensa por correos o mensajería de medicamentos a enfermos crónicos[6].
A nivel comunitario, ya en la década de los 90, con Directiva 97/7/CE del Parlamento Europeo y del Consejo, de 20 de mayo de 1997, relativa a la protección de los consumidores en materia de contratos a distancia; y la conocida Directiva sobre el comercio electrónico[7] adoptada tres años más tarde, la protección de la salud pública pasó a configurarse como principio básico que justificaba la prohibición de la comercialización de determinados bienes o servicios fruto de contratos celebrados a distancia (“en especial de medicamentos”, artículo 14 de la Directiva de 1997) o la restricción a la libertad de prestación de servicios (artículo 3.4 de la Directiva de 2000).
La Directiva sobre el comercio electrónico fue incorporada al ordenamiento jurídico español a través de la Ley 34/2002, de 11 de julio, de servicios de la sociedad de información y de comercio electrónico. Incluso cuando en su disposición adicional segunda se preveía la posibilidad del uso de Internet para medicamentos y productos sanitarios, en ésta se traslada su regulación a “su legislación específica”, norma que no llegará hasta el 2013, como veremos más adelante.
Aunque contemos con un Código comunitario sobre medicamentos para uso humano[8] e infinidad de Directivas, debemos tener en cuenta que a día de hoy no existe una armonización comunitaria plena en muchos aspectos del Derecho farmacéutico, lo que incluye la regulación de la venta de medicamentos a los consumidores finales. Este factor, unido al incremento de transacciones a distancia como manifestación del principio de libertad de circulación de mercancías y del auge del comercio electrónico, dieron lugar al litigio entre la Deutscher Apothekerverband Ev y 0800 DocMorris NV y Jacques Waterval[9]. El caso fue visto por el Tribunal de Justicia de la Unión Europea y verdaderamente marcó un antes y un después en la venta por Internet de medicamentos a consumidores finales.
DocMorris (parte demandada, junto con el Sr. Waterval, farmacéutico) es una sociedad anónima de los Países Bajos —de una localidad cercana a la frontera con Alemania— que, junto con la dispensa tradicional de medicamentos en una Oficina de Farmacia abierta al público, vendía medicamentos por correspondencia tras haber recibido la petición a través de su página web. Por Internet vendían exclusivamente medicamentos autorizados legalmente en Alemania o en Países Bajos, y tanto la Oficina de Farmacia física como su página web estaban autorizadas y supervisadas por la autoridad neerlandesa competente.
La Deutscher Apothekerverband (parte demandante) es una asociación alemana de farmacéuticos que decidió iniciar acciones legales, en tanto que parte de los compradores de DocMorris eran alemanes y la legislación nacional enunciaba expresamente: 1) la prohibición de importar medicamentos para uso humano cuya venta se reserva exclusivamente a farmacias alemanas; 2) la prohibición de publicitar los medicamentos sujetos a receta médica, la venta por correspondencia de medicamentos dispensables exclusivamente por farmacias, y la venta de medicamentos por importación individual.
El TJUE concluyó que:
1) Según se planteaba en la normativa alemana controvertida, la prohibición de importación de medicamentos para uso humano con venta reservada exclusivamente a las farmacias alemanas es contraria al principio de libre circulación de mercancías, pues impide el acceso al mercado de los consumidores finales del Estado importador o crea barreras que no existen con los productos nacionales (FJ nº 76);
2) Sin embargo, debe distinguirse entre medicamentos sujetos a prescripción médica y los que no: la prohibición alemana estaría justificada solamente si son medicamentos sujetos a prescripción médica, a la luz del artículo 30 del Tratado de Roma[10];
3) El mismo tratamiento merecen los casos de reimportación (FJ nº 134);
4) Bajo el artículo 88 del Código comunitario sobre medicamentos para uso humano y las inmediatamente anteriores decisiones del Tribunal, únicamente se prohíbe la publicidad de medicamentos no autorizados y de medicamentos sujetos a prescripción médica, por lo que la normativa alemana tampoco se ajusta en estos extremos al Derecho comunitario.
La sentencia pone de manifiesto una vez más la tradicional desconfianza del sector público en el sector privado, hasta tal punto que algunos legisladores nacionales se aprovechaban cuasi-indiscriminadamente de las excepciones por salud pública contempladas por las normas comunitarias. En contraposición, el TJUE únicamente admite la alegación y aplicación de este principio cuando recaiga sobre medicamentos sí sujetos a prescripción médica.
No exageramos al afirmar que la doctrina sentada por el Tribunal europeo causó revuelo. Durante el proceso judicial, todos los Estados participantes se posicionaron a favor de del demandante (Alemania, Irlanda, Grecia, Austria y Francia) y las reacciones posteriores en España no fueron muy dispares[11]. Incluso cuando la comunidad farmacéutica más tradicional estaba en contra, el caso DocMorris provocó la introducción del artículo 85 quater y quinquies en el referido Código comunitario mediante la Directiva 2011/62/UE[12].
RÉGIMEN JURÍDICO ACTUAL EN ESPAÑA
3.1. INTRODUCCIÓN
El régimen jurídico de la venta en línea de medicamentos en España consta de tres ejes clave: 1) el artículo 2.5 de la actualmente derogada Ley 29/2006, de garanti?as y uso racional de los medicamentos y productos sanitarios; 2) Real Decreto núm. 870/2013, de 8 de noviembre, por el que se regula la venta a distancia al público, a través de sitios web, de medicamentos de uso humano no sujetos a prescripción médica; y 3) Reglamento de ejecución (UE) nº 699/2014, de 24 de junio[13]. Los listados de “Preguntas más frecuentes” creados por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y los Códigos éticos y de conducta de las Asociaciones —como el Código Ético de la Farmacia Comunitaria, elaborado por la Asociación Española de Farmacia Familiar y Comunitaria— son valiosos como soporte interpretativo.
En el Real Decreto 870/2013, de 8 de noviembre (en adelante, “Real Decreto”) se fundamenta la competencia para dictar la norma en el artículo 149.1.16º de la Constitución Española de 1978, competencia que además se atribuye en exclusiva al Estado.
Sin embargo, la anteriormente mencionada STC 152/2003, de 17 de julio de 2003, recoge que la competencia exclusiva estatal en legislación sobre productos farmacéuticos no puede comportar tal expansión que anule indebidamente las competencias en materia de establecimientos farmacéuticos que todas las CCAA han asumido a través de sus respectivos Estatutos de Autonomía, siempre que la regulación correspondiente se oriente al establecimiento de reglas o criterios que atiendan al ejercicio ordinario de esta actividad de los establecimientos de farmacia, sea de índole técnica o meramente de entrega material, y no ponga en cuestión los principios relativos a garantizar la seguridad de las prescripciones médicas y, con ello, la salud de los pacientes[14]. En consecuencia, prima facie no parece haber obstáculo jurídico para que eventualmente las Comunidades Autónomas acojan y adapten esta normativa estatal.
En el artículo 2.5 de la Ley 29/2006 se enuncia de forma sucinta la prohibición de vender a distancia (“por correspondencia y por procedimientos telemáticos”) medicamentos y productos sanitarios que requieran una receta, para posteriormente ordenar el desarrollo legislativo del régimen de la venta a distancia de tales productos no sujetos a prescripción médica (para uso humano o veterinario), y finalmente indica los requisitos básicos que deberá tener tal ulterior regulación. Han tenido que pasar más de siete años desde la publicación de dicha Ley para que en España se cumpla con el principio de seguridad jurídica y se apruebe el Real Decreto.
Así, los agentes interesados en esta modalidad de dispensación estuvieron durante demasiados años en la paradójica situación de que una Ley les permitía vender online pero, por falta de desarrollo reglamentario, el artículo 2.5 de la Ley 29/2006 no tenía aplicación práctica. Es más: éste era un precepto vacío de contenido, pero el artículo 101.2.C.11º de la Ley ya entonces contemplaba como infracción muy grave “vender medicamentos a domicilio o a trave?s de internet o de otros medios telema?ticos o indirectos, en contra de lo previsto en esta Ley o incumpliendo las disposiciones que regulen dicha modalidad de venta”[15].
Por su parte, el Reglamento de ejecución (UE) nº 699/2014 se limita a configurar el logotipo común a publicar en todas las páginas web de venta de medicamentos provenientes de los Estados Miembros, como explicaremos posteriormente.
Así las cosas, en lo que sigue nos centraremos en las disposiciones del Real Decreto 870/2013, de 8 de noviembre.
3.2. OBJETO: MEDICAMENTOS PARA USO HUMANO SIN RECETA.
Con carácter preliminar, debemos señalar que, a la vez que norma desarrolladora del artículo 2.5 de la Ley de 2006, el Real Decreto cuenta con un doble propósito: establecer un marco normativo que permita la venta legal de medicamentos para uso humano no sujetos a prescripción adquiridos por Internet y con las garantías sanitarias necesarias, y proporcionar a los ciudadanos criterios que les permitan distinguir los sitios web de venta lícita de medicamentos de los que no lo son.
El segundo propósito se comprende más adecuadamente en contexto con el espíritu de la Directiva, que es la prevención de la entrada de medicamentos falsificados en la cadena de suministro legal. Esto significa que el fundamento de la Directiva no es necesariamente armar un sistema de venta online de medicamentos eficiente, por ejemplo, sino evitar que el consumidor final adquiera medicamentos que no han pasado por los procesos y controles preceptivos legales, y que por tanto presentan un elevado nivel de riesgo para la salud.
El primer artículo del Real Decreto delimita claramente qué tipo de productos podrán ser vendidos por Internet a partir de su entrada en vigor: los medicamentos a) vendidos a distancia por sitios web de Oficinas de Farmacia; b) de uso humano; c) elaborados industrialmente; d) no sujetos a prescripción médica. Apuntar que la calificación de medicamento sujeto o no a prescripción médica corresponde exclusivamente a la Agencia Española de Medicamentos y Productos Sanitarios, en el momento en que autorizan la comercialización de un medicamento.
Éste continúa excluyendo de su ámbito de aplicación los vendidos por otros servicios de la sociedad de información distintos a las páginas web[16]; b) los medicamentos veterinarios, estén sujetos o no a prescripción médica; c) los preparados oficinales[17]. Se añade también la prohibición de vender medicamentos que no hayan sido autorizados de acuerdo a la normativa aplicable. Asimismo, el Real Decreto no incluye tampoco a los productos de cuidado personal, cosméticos o preparados alimenticios infantiles[18].
Merece destacar que la actividad que se está regulando con el Real Decreto es la dispensación de medicamentos al consumidor final, no la distribución o exportación de medicamentos. La entrada en vigor de esta norma no afecta a la prohibición que recae sobre las Oficinas de suministrar medicamentos a otra u otras farmacias o entidades de distribución, pues solamente están habilitados para llevar a cabo tales actividades los laboratorios farmacéuticos y las entidades de distribución (artículos 67 y 73 del Real Decreto Legislativo 1/2015, de 24 de julio).
3.3. REQUISITOS. EL LOGOTIPO COMÚN EUROPEO COMO SINÓNIMO DE LEGALIDAD.
Para iniciar la práctica de esta modalidad de dispensación, el Real Decreto exige (artículos 3 y 4) que:
- - Se cuente con una Oficina de Farmacia (física) abierta al público y legalmente autorizada;
- - Ésta haya efectuado una comunicación previa de actividad a las autoridades competentes de la Comunidad Autónoma[19] con una antelación de mínimo 15 días al inicio de la actividad de venta a distancia, así como la producción de cualquier modificación en los datos comunicados y el cese de la actividad (también con una antelación de 15 días). Por tanto, no se requiere una autorización administrativa (control ex post).
- - Se haya habilitado, pero no activado, una página web que reúna los requisitos del artículo 8 del Real Decreto y, especialmente, donde los medicamentos ofertados se ajusten a los rasgos indicados en el apartado anterior.
La comunicación previa es bastante concisa, pues se limita a los datos identificativos (nombre y apellidos) del farmacéutico o farmacéuticos titulares o regente, la dirección de la farmacia desde la que se llevará a cabo el ecommerce, la fecha de inicio de las actividades de oferta al público por la página web, la dirección del sitio web y, finalmente, información sobre los procedimientos de envío de los medicamentos al consumidor final.
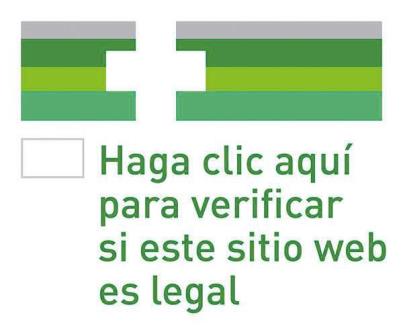
Al comparar estos requisitos con los del artículo 85 quater de la Directiva que venimos mencionando, se observa que el legislador español ha optado por exigir información sobre los envíos en vez de la cláusula de información opcional sobre la clasificación de los medicamentos ofrecidos al público por esta vía. Consideramos que es una buena decisión, pues evita a los farmacéuticos españoles tener que realizar comunicaciones constantes a la Autoridad si cambian los productos disponibles en su sitio web.
Anteriormente decíamos que uno de los propósitos del Real Decreto era proporcionar al consumidor final criterios que le permitiesen distinguir entre páginas web de venta legal de medicamentos de las que no. Así pues, encontramos en un plano paralelo a los derechos que asisten a los compradores en las ventas online legales la creación de un logotipo común.
Su diseño se hizo público hace dos años en el Reglamento de ejecución (UE) nº 699/2014, cumpliendo así con el encargo contenido en la Directiva 2001/83/CE. Desde su entrada en vigor en julio de 2015, el logotipo debe aparecer en toda página web de dispensación de medicamentos legal sita en un Estado Miembro.
Cuando un potencial comprador clicka en el enlace de una farmacia online española, le dirigirá a la página web creada al efecto por la AEMPS (artículo 6 del Real Decreto) donde se incluye un listado de las Oficinas de Farmacia que venden medicamentos sin receta legalmente por Internet[20]. Así, si observa que la página web en la que iba a realizar un pedido no está en la lista, es un indicador inequívoco de ilegalidad o incluso de medicamentos falsificados.
3.4. OBLIGACIONES Y RESTRICCIONES DEL FARMACÉUTICO EN EL PROCESO DE VENTA.
La primera obligación que se produce en esta modalidad de dispensación es que en la venta debe intervenir un farmacéutico desde su Oficina de Farmacia, directamente y sin intermediarios que gestionen la venta por cuenta de la Oficina. Concretamente, esta obligación se configura como “inexcusable” en el Real Decreto.
Moreno Liso[21] se preguntaba en el 2006 si la figura del farmacéutico se limita única y exclusivamente al profesional titulado en la Universidad o si por el contrario un auxiliar técnico o un técnico en farmacia (con titulación de Grado Medio y habilitado para dispensar medicamentos con y sin receta en una Oficina de Farmacia tradicional) entrarían dentro de tal concepto. Es una duda que el Reglamento no ha resuelto y que aún no ha podido ser tratada por la jurisprudencia.
La norma veta la anonimidad en los pedidos y contempla unos datos mínimos que el comprador deberá manifestar[22], precisamente porque no basta con que intervenga un farmacéutico, sino que antes de proceder a la dispensación debe realizar un asesoramiento personalizado y adecuado, ex artículo 3.2 del Real Decreto. Por remisión del precepto a los artículos 19.4 y 84.1 de la Ley 29/2006, de 26 de julio, entendemos que el papel del farmacéutico como asesor busca que se informe, aconseje e instruya al consumidor final sobre su correcta utilización, se contribuya a la utilización racional de los medicamentos e incluso se prevé que pueda proporcionar sistemas personalizados de dosificación (si el consumidor lo solicita).
Así, el farmacéutico tiene la obligación[23] de contactar con el usuario para recabar información adicional, realizar recomendaciones más exactas y resolver las dudas que tenga respecto al uso del medicamento adquirido. Este deber de información se reitera más tarde, en la fase de entrega material al usuario de medicamento. En ningún caso esta obligación se puede sustituir por un enlace a una página web de autodiagnóstico o automedicación.
En lo relativo a la fase del transporte de medicamento y entrega al usuario, el artículo 11 señala la atribución de responsabilidad a la Oficina de Farmacia por las alteraciones o disminuciones en la calidad de los medicamentos, con independencia de que el acto del suministro lo realice la propia farmacia o un tercero.
Como regla general, los medicamentos no se pueden devolver una vez hayan sido dispensados y entregados al cliente, a no ser que a) hayan sido suministrados erróneamente; b) no se correspondan con el pedido realizado; c) hayan sido dañados durante el transporte; o d) el plazo de entrega ha superado el 50% del tiempo determinado en el momento de la compra por causas no imputables al consumidor. En cualquiera de estos casos la Oficina dispensadora tiene la obligación de aceptar las devoluciones, destinar dichos medicamentos íntegramente para su destrucción y en el supuesto d) el usuario tiene derecho al reintegro del importe satisfecho.
Aunque por la extensión debida del trabajo no podremos analizar la cuestión, el artículo 3.5 del Real Decreto, hace referencia expresa a la dispensación intracomunitaria con origen en una oficina online española. Mientras que DocMorris aplicaba desde un principio las normas y requisitos procedentes de la legislación que casuísticamente fuese más severa (la alemana o la neerlandesa), el legislador español ha optado por exigir a la vez tanto los requisitos exigidos en el Estado exportador (España) como los del Estado Miembro importador. Ello incluye la misma venta y condiciones de dispensación, pero también el etiquetado, prospecto y clasificación.
Finalmente, el artículo 10. 4 del Real Decreto impone la obligación a la Oficina Farmacéutica de crear un registro de los pedidos suministrados, con información exhaustiva de cada uno de ellos. Cada dato registrado deberá mantenerse al menos dos años desde la dispensación del respectivo medicamento.
Sin duda alguna es un régimen muy garantista para el consumidor final, más incluso que el establecido en las dispensaciones físicas tradicionales, en tanto que pasamos de una “dispensación informada” a una relación farmacéutico - cliente constante desde que se inicia el proceso de compra hasta después de su consumo (artículo 10.8). Todo ello para, en definitiva, alcanzar una situación de auto-cuidado sin riesgos o con riesgos mínimos.
3.5. BREVE MENCIÓN A LA PUBLICIDAD DE LOS MEDICAMENTOS.
Las restricciones en publicidad de medicamentos merecen un análisis separado al de la venta online, pero aquí nos centraremos en sus rasgos más elementales.
De los artículos 87 y ss. del Código comunitario previamente citado y de variada jurisprudencia del TJUE[24] extraemos varias reglas que se han incorporado en nuestro ordenamiento jurídico de forma cuasi íntegra en el Real Decreto, como en la Ley 29/2006 y el Real Decreto Legislativo 1/2015 que la derogó.
- - Primero: que queda prohibida toda publicidad[25] de un medicamento que no haya obtenido autorización de comercialización o que esté sujeto a prescripción médica.
- - Segunda: que en los supuestos en los que la publicidad esté permitida, debe ajustarse única y exclusivamente a la información que figure literalmente en el prospecto del producto (artículo 9 del Real Decreto) y, sobre todo, no debe promocionar un uso irracional de la medicación.
- - Tercera: para con la venta realizada online por los farmacéuticos en España, ello implica que “no podrán realizarse regalos, premios, obsequios, concursos, bonificaciones o actividades similares” (artículo 3.4 del Real Decreto).
4. CONCLUSIONES.
En primer término, es pertinente la liberalización de las Oficinas de Farmacia como una medida destacable para aumentar la eficacia del sector farmacéutico en España, como es de ver en el Informe de 2015 de la CNMC. La constante reducción de la partida sanitaria en los Presupuestos Generales ha probado ser insuficiente para oxigenar el sistema y, si no se actúa, se corre el serio riesgo de no poder proteger la salud pública debidamente.
En segundo término, una conclusión clave que extraemos de las secciones II y siguientes es que el legislador español ha tenido la intención de no incorporar al ordenamiento jurídico ni más ni menos que lo que el TJUE y la Directiva 2011/62/UE solicitaban de los Estados Miembros, e incluso muy a destiempo —recordemos que la disposición que presentaba por primera vez a las farmacias online es del 2006 y se tuvo que esperar al Real Decreto hasta el 2013 para que fuese aplicable—.
Una ulterior conclusión es que el régimen jurídico planteado es eminentemente protector con el consumidor final y, a su vez, impone obligaciones y un régimen de responsabilidad que a primera vista pueden resultar muy gravosas para una Oficina de Farmacia habitual.
Ambas decisiones son entendibles si tenemos en cuenta la idiosincrasia del sector farmacéutico español. No solamente somos uno de los países europeos en los que más Oficinas de Farmacia hay por habitante[26] sino que además las corrientes tradicionales se oponen (o, más bien, “demonizan”[27]) a la dispensación a distancia, según hemos señalado en su momento. Merece la pena señalar a que, en marzo de 2016 hay un total de 245 farmacias online, en oposición a las 21.559 presenciales a finales del 2015[28]. La práctica totalidad de éstas son de pequeño tamaño, con una media de dos farmacéuticos por Oficina.
Por lo reciente del Real Decreto no se han producido litigios, así que no podemos determinar aún si ha conseguido resolver el conflicto entre los farmacéuticos a favor y en contra del e-commerce o si, simplemente, no se está aplicando por el desequilibrio coste / beneficio que puede llegar a provocar el cumplimiento de la norma. En cualquier caso, el marco jurídico sí resuelve algunas preocupaciones y argumentos contrarios al e-commerce más habituales[29] [30]: los envases y medicamentos llegan deteriorados a su destino (régimen de responsabilidad del farmacéutico); pondrá en peligro las farmacias tradicionales (prohibición de publicidad, obsequios y promociones, y obligación de contar con una Oficina presencial abierta); el asesoramiento será de peor calidad (el seguimiento del farmacéutico debe ser permanente y el consumidor cuenta con información nítida y por escrito), etc.
Cerramos este trabajo con unos últimos apuntes sobre el futuro de esta materia. Es previsible en un futuro muy próximo que el legislador comunitario extienda el régimen analizado a los medicamentos para uso veterinario[31]. Además, deberemos estar atentos a las implicaciones sobre la normativa que tiene la implementación del eHealth Action Plan 2012-2020, trazado por la Comisión Europea.
BIBLIOGRAFÍA
ASPIME (2015) “Informe Anual de Oficinas de Farmacia 2015”, XVI Edición. Disponible en la página web www.correofarmaceutico.com.
COMISIÓN NACIONAL DE LOS MERCADOS Y LA COMPETENCIA (2015) “E/CNMC/003/15 Estudio sobre el mercado de distribución minorista de medicamentos en España”. Informe disponible en la página web www.cnmc.es
CONSEJO GENEERAL DE COLEGIOS OFICIALES DE FARMACÉUTICOS (2009) “Venta de medicamentos en Internet: riesgo de falsificaciones”. Disponible en la página web www.portalfarma.com
CONSEJO GENERAL DE COLEGIOS OFICIALES DE MÉDICOS DE ESPAÑA (2014) “Informe sobre el sector farmacéutico”. Disponible en la página web www.cgcom.es
EUROPEAN ASSOCIATION OF MAIL SERVICE PHARMACIES (EAMSP) (27 de febrero de 2016) “EAMSP welcomes the European Parliament’s preliminary vote on veterinary medicinal products”. Publicada en la página web www.eamsp.org
MIGUEL REDONDO, A. (2014) “La falsificación de medicamentos y la venta en Internet, un problema de salud pública”. RqR Enfermería Comunitaria (Revista SEAPA). 2014 Ago ; 2 (3): 43-46.
MORENO LISO, L. (2006) “La venta de medicamentos en Internet” Revista de la contratación electrónica, ISSN 1576-2033, Núm. 72, 2006, págs. 3-37.
PEÑA, P. (2004). “Sinopsis del artículo 43 de la Constitución Española”. Disponible en la página web www.congreso.es
PHARMACEUTICAL GROUP OF THE EUROPEAN UNION (PGEU) (2014) “PGEU Annual Report: Promoting Efficiency, Improving Lives”. Disponible en la página web www.pgeu.eu/en/library
PORTALFARMA (2004) “Entrevista a Pedro Capilla, nuevo Presidente de la Agrupacio?n Farmace?utica Europea (PGEU)”. Publicada en la página web portalfarma.com. “Hemos seguido de cerca el caso Doc Morris (…) Las sentencias hay que acatarlas, pero consideramos que e?sta en concreto no es una garanti?a para la salud del ciudadano, sino todo lo contrario”.
SARRATO MARTÍNEZ, L. (2006) “Algunas consideraciones sobre la venta de medicamentos por Internet” Actualidad Jurídica Aranzadi num.711/2006.
THE EUROPEAN MEDICINES AGENCY (Fecha indeterminada) “Buying medicines online”. Nota web en su página www.ema.europa.eu.
[1] Comisión Nacional de los Mercados y la Competencia (2015) “E/CNMC/003/15 Estudio sobre el mercado de distribución minorista de medicamentos en España”. Informe disponible en la página web www.cnmc.es
[2] “Compete a los poderes públicos organizar y tutelar la salud pública a través de medidas preventivas y de las prestaciones y servicios necesarios. La ley establecerá los derechos y deberes de todos al respecto.”.
[3] Cita textual de PEÑA, P. (2004). “Sinopsis del artículo 43 de la Constitución Española”. Disponible en la página web www.congreso.es
[4] Consejo General de Colegios Oficiales de Médicos de España (2014) “Informe sobre el sector farmacéutico”. Disponible en la página web www.cgcom.es
[5] Dictamen Motivado abierto el 28 de junio de 2006 contra el modelo farmacéutico español. En noviembre de 2011, la propia Comisión lo retiró. También resulta interesante la STJUE de 1 de junio de 2010, nº C-570/07 t C-571/07.
[6] STC 152/2003, de 17 de julio de 2003. Concretamente, apartados 6 y 7 de los Fundamentos Jurídicos.
[7] Directiva 2000/31/CE del Parlamento Europeo y del Consejo, de 8 de junio de 2000, relativa a determinados aspectos jurídicos de los servicios de la sociedad de la información, en particular el comercio electrónico en el mercado interior (Directiva sobre el comercio electrónico)
[8] Directiva 2001/83/CE del Parlamento Europeo y del Consejo de 6 de noviembre de 2001 por la que se establece un código comunitario sobre medicamentos para uso humano.
[9] STJUE de 11 de diciembre de 2003, nº C-322/2001.
[10] Artículo 30 del Tratado de Roma (Tratado Constitutivo de la Comunidad Económica Europea): “Las disposiciones de los arti?culos 28 y 29 no sera?n obsta?culo para las prohibiciones o restricciones a la importacio?n, exportacio?n o tra?nsito justificadas por (…) proteccio?n de la salud y vida de las personas y animales (…)”. Véase también el Fundamento Jurídico nº 124.
[11] PORTALFARMA (2004) “Entrevista a Pedro Capilla, nuevo Presidente de la Agrupacio?n Farmace?utica Europea (PGEU)”. Publicada en la página web portalfarma.com. “Hemos seguido de cerca el caso Doc Morris (…) Las sentencias hay que acatarlas, pero consideramos que e?sta en concreto no es una garanti?a para la salud del ciudadano, sino todo lo contrario”.
[12] Directiva 2011/62/UE del Parlamento Europeo y del Consejo, de 8 de junio de 2011, que modifica la Directiva 2001/83/CE por la que se establece un código comunitario sobre medicamentos de uso humano, en lo relativo a la prevención de la entrada de medicamentos falsificados en la cadena de suministro legal.
[13] Reglamento de ejecución (UE) nº 699/2014 de la Comisión de 24 de junio de 2014 sobre el diseño del logotipo común para identificar a las personas que ofrecen al público medicamentos por venta a distancia y los criterios técnicos, electrónicos y criptográficos a efectos de la verificación de la autenticidad de dicho logotipo.
[14] Fundamento Jurídico 7º. En nuestro caso es la Llei 31/1991, de 13 de desembre, d'ordenació farmacèutica de Catalunya.
[15] Sobre los supuestos de medicamentos para uso veterinario, véase (entre otras) la SAN, Sala de lo Contencioso, 53/2014 del 2 de julio.
[16] La página web distafarma.aemps.es, elaborada por la AEMPS por obligación del artículo 85 quater.4 de la Directiva y el artículo 16 del Real Decreto, publicó un listado de preguntas más habituales sobre el Real Decreto y confirmó la prohibición de las apps como portal de venta de medicamentos.
[17] Artículo 2.J del Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios. Se define como preparado oficinal “aquel medicamento elaborado según las normas de correcta elaboración y control de calidad establecidas al efecto y garantizado por un farmacéutico o bajo su dirección, dispensado en oficina de farmacia o servicio farmacéutico, enumerado y descrito por el Formulario Nacional, destinado a su entrega directa a los enfermos a los que abastece dicha farmacia o servicio farmacéutico”.
[18] No se consideran medicamentos atendiendo a la literalidad del artículo 8.1 del Real Decreto Legislativo 1/2015, de 24 de julio.
[19] En el caso de Cataluña, la Autoridad competente que debe recibir la comunicación es el Departament de Salut. Posteriormente, ésta remitirá a la AEMPS los datos relativos al sitio web para que pueda incluirla en el sitio web de Distafarma (artículo 5.1 del Real Decreto).
[20] THE EUROPEAN MEDICINES AGENCY (Fecha indeterminada) “Buying medicines online”. Nota web en su página www.ema.europa.eu.
[21] Moreno Liso, L. (2006) “La venta de medicamentos en Internet” Revista de la contratación electrónica, ISSN 1576-2033, Núm. 72, 2006, págs. 3-37.
[22] Se requiere expresamente el nombre y apellidos, teléfono, correo electrónico y dirección postal del comprador. Además, son relevantes los requisitos de la Ley Orgánica 15/1999, de 13 de noviembre, de Protección de Datos de Carácter Personal, pues recordemos que las cuestiones de salud son datos de carácter sensible.
[23] Aunque en el texto del precepto parezca plantearse como una mera posibilidad, hemos visto que en el artículo 2.5 de la Ley 29/2006 es una exigencia ineludible para proceder a la dispensación del medicamento.
[24] Un pronunciamiento paradigmático se conntiene en la STJUE de 5 de mayo de 2011, nº C-316/09. Son también relevantes las SSTJUE de 2 de abril de 2009, nº C-421/07; de 8 de noviembre de 2007, nºC-374/05.
[25] El artículo 86.1 del Código comunitario define la “publicidad de medicamentos” como toda forma de oferta informativa, de prospección o de incitación destinada a promover la prescripción, la dispensación, la venta o el consumo de medicamentos.
[26] PHARMACEUTICAL GROUP OF THE EUROPEAN UNION (PGEU) (2014) “PGEU Annual Report: Promoting Efficiency, Improving Lives”. Disponible en la página web www.pgeu.eu/en/library
[27] MIGUEL REDONDO, A. (2014) “La falsificación de medicamentos y la venta en Internet, un problema de salud pública”. RqR Enfermería Comunitaria (Revista SEAPA). 2014 Ago ; 2 (3): 43-46. En su artículo, se pone de manifiesto la visión conservadora de los enfermeros en la materia.
[28] ASPIME (2015) “Informe Anual de Oficinas de Farmacia 2015”, XVI Edición. Disponible en la página web www.correofarmaceutico.com.
[29] SARRATO MARTÍNEZ, L. (2006) “Algunas consideraciones sobre la venta de medicamentos por Internet” Actualidad Jurídica Aranzadi num.711/2006.
[30]CONSEJO GENEERAL DE COLEGIOS OFICIALES DE FARMACÉUTICOS (2009) “Venta de medicamentos en Internet: riesgo de falsificaciones”. Disponible en la página web www.portalfarma.com
[31] EUROPEAN ASSOCIATION OF MAIL SERVICE PHARMACIES (EAMSP) (27 de febrero de 2016) “EAMSP welcomes the European Parliament’s preliminary vote on veterinary medicinal products”. Publicada en la página web www.eamsp.org